لقد اعتدنا رؤية رموز العوامل المساعدة أثناء دراسة التفاعلات الكيميائية فوق وتحت سهم التفاعل (←أو ⇋). وهذه الرموز إما رمز الحرارة والذي يعبر عنه بالمثلث، أو حرف ال (P) الذي يدل على الضغط، أو رمز من رموز العناصر الكيميائية كالبلاتين (\xrightarrow{\text{Pt}}). وهذا الأخير هو الذي نحن بصدده الآن.
وفي الواقع تعبر هذه الرموز عن مواد كيميائية تضاف إلى التفاعلات الكيميائية لغرض تسريعها أو إتمامها. وتسمى العملية التي تضاف فيها مادة كيميائية لزيادة سرعة التفاعل ب "عملية الحفز". أما المواد المضافة، يطلق عليها "المحفزات" أو "المواد الحفازة".
وفي هذا المنشور سنقوم بمناقشة أنواع الحفز، وكذلك تصنيف وخواص المحفزات بالإضافة إلى آلية عملها. لكن دعونا نعرف أولا ما هي عملية الحفز؟.
ما هي عملية الحفز؟
في الكيمياء، الحفز (Catalysis) هو تغيير معدل التفاعل الكيميائي (عادة يكون تسريع)، وذلك بإضافة مادة كيميائية لا تستهلك أثناء التفاعل[1]. وتسمى هذه المادة ب "المحفز" أو "الحفاز" (Catalyst)، وسنناقشه أثناء شرح المحفزات. لكن دعونا نركز أولا على فهم عملية الحفز.
يمكن وصف عملية الحفز بناء على نوع المواد الحفازة المستخدمة أو الوسط الذي تتم فيه العملية. لذلك يتم تقسيم عملية الحفز بشكل عام إلى أنواع مختلفة كما سيأتي.
أهمية الحفز في التصنيع الكيميائي
أنواع الحفز
فيما يلي أنواع الحفز حسب الوسط الذي يحدث فيه التفاعل:
التحفيز المتجانس
في التحفيز المتجانس يكون الحفاز والمواد المتفاعلة من نفس الطور، حيث يكون المحفز مذابا في الوسط الذي توجد فيه المتفاعلات كما في الحفز "سائل - سائل".
على سبيل المثال، يتم تحفيز التحلل المائي للسكر بواسطة أيونات H+ التي يوفرها حمض الكبريتيك، كما في المعادلة التالية:
\text{C$_{12}$H$_{22}$O$_{11}$(aq)} + \text{H$_2$O(l)} \xrightarrow{\text{H$_2$SO$_4$(l)}} \underset{\text{جلوكوز} } {\text{C$_6$H$_{12}$O$_6$(aq)}} + \underset{فراكتوز} {\text{C$_6$H$_{12}$O$_6$(aq)}}
- مميزات الحفز المتجانس
-
- يكون المحفز في اتصال جيد مع المتفاعلات.
- عيوب الحفز المتجانس
-
- يحتاج عملية الحفز إلى الفصل بعد التفاعل.
- قد يكون من الصعب استعادة المحفز لأن درجة حرارة التقطير يمكن أن تدمر المحفز[2] .
الحفز غير المتجانس
ففي الحفز غير المتجانس يكون المحفز والمتفاعلات في طورين مختلفين؛ كأن يكون المحفز مادة صلبة (عادة) والمتفاعلات من الطور الغازي أو السائل كما في عمليات "صلب - غاز" و "صلب - سائل". يمثل هذا النوع النسبة الأكبر من العمليات الصناعية الكيميائية المحفزة.
من الأشياء التي يختلف فيها الحفز غير المتجانس عن المتجانس؛ أن الأول يحدث فيه تقليل كبير في طاقة التنشيط[3]. وهناك عدة عوامل تؤثر على كفاءة الحفاز غير المتجانس وهي[5]:
- إجمالي مساحة السطح.
- عدد المواقع النشطة لوحدة كمية من المحفز.
- طريقة تصنيع المحفز والمعالجة المسبقة له.
من أمثلة الحفز غير المتجانس عملية هابر-بوش لتحضير الأمونيا والتي يستخدم فيها كمية صغيرة من حفاز أكسيد البوتاسيوم الألومنيوم. تتم هذه العملية تحت ضغوط ط ودرجات حرارة عالية كما يلي:
\text{3H$_2$} + \text{N$_2$} \xrightarrow[\text{250atm/550°C}] {\text{K$_2$O/Al$_2$O$_3$}} \text{2NH$_3$}
- مميزات الحفز غير المتجانس
-
- لا توجد صعوبة في فصل وإعادة تدوير المحفز.
- عيوب الحفز غير المتجانس
-
- يوجد تركيز فعال أقل للمحفز، لأن التفاعل يحدث فقط على السطح النشط المكشوف[2] .
التحفيز التلقائي
في التحفيز التلقائي يكون المحفز أحد نواتج التفاعل الكيميائي، ويساهم في تسريع عملية التفاعل. يتميز هذا النوع بأن معدل التفاعل يكون بطيئا في البداية، لكنه يزداد مع مرور الزمن.
الحفز الإنزيمي أو الحيوي
تعتبر الإنزيمات (عبارة عن بروتينات) مواد حفازة ذات انتقائية عالية، وهي التي تقوم بتحفيز التفاعلات الكيموحيوية داخل الكائنات الحية؛ لذلك يتم تسمية هذا النوع من الحفز ب "الحفز الحيوي" أو "الحفز الإنزيمي".
على سبيل المثال، يقوم إنزيم الأمليز الذي يوجد في اللعاب والبنكرياس بتحويل النشأ (وهي عبارة عن سكريات عديدة) إلى سكر ثنائي (مالتوز)؛ ثم يقوم إنزيم المالتيز بتحويل الأخير إلى سكر أحادي (جلوكوز). كما في المعادلة التالية:
\text{نشأ} \xleftarrow{\text{أمليز}} \text{مالتوز} \xleftarrow{\text{مالتيز}} \text{جلوكوز}
تصنيف المحفزات Classification of Catalysts
كما أشرنا سلفا، فإن المحفزات عبارة عن مواد كيميائية تضاف إلى وسط التفاعل لتغيير معدل حدوثه، وقلنا أنها لا تستهلك أثناء التفاعل. وتذكر أننا قلنا عادة تعمل على تسريع العملية، ولم نقل دائما. وعلى هذا الأساس يتم تصنيف المحفزات إلى:
المحفزات الإيجابية
المحفزات الإيجابية هي تلك التي تؤدي إلى زيادة سرعة التفاعل عن طريق تقليل طاقة التنشيط. وهي الأكثر شيوعا. ومن أمثلة ذلك، عملية هابر-بوش التي سبق شرحها.
المحفزات السلبية
هناك بعض المحفزات التي تستخدم لغرض إبطاء سرعة التفاعل، وتسمى ب "المحفزات السلبية" وهي تقوم بذلك من خلال زيادة طاقة التنشيط. يمكن استخدام المحفزات السلبية في منع تحلل بعض المواد الكيميائية. كما في حالة بيروكسيد الهيدروجين، حيث يستخدم الأسيتانيلد كمحفز سلبي لتقليل تفاعل تحلل لبيروكسيد الهيدروجين[4].
كيف تعمل المحفزات (آلية العمل)؟
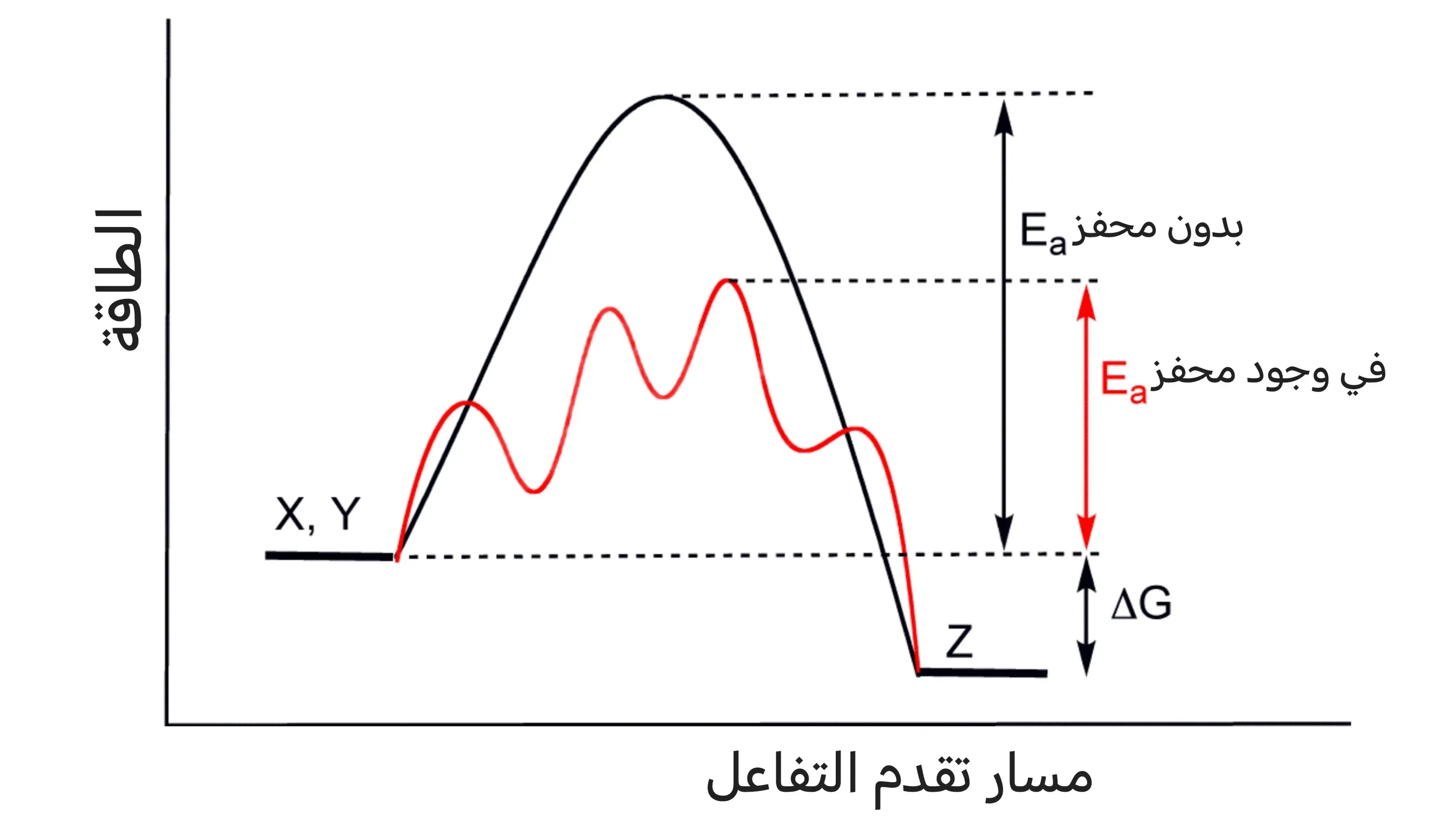
يعتمد آلية عمل المحفزات على تغيير طاقة التنشيط، يمكن أن يؤدي ذلك (عادة) إلى زيادة سرعة التفاعل كما في المحفزات الإيجابية؛ حيث تقوم بتوفير مسار أقصر للمواد المتفاعلة، وبالتالي تقل طاقة التنشيط.
أما إذا زادت طاقة التنشيط سيؤدي ذلك إلى إبطاء معدل التفاعل، كما تفعل المحفزات السلبية، وذلك عن طريق توفير مسار أطول للمتفاعلات. ويعد تغيير معدل التفاعل من أهم خواص المحفزات.
يحدث الحفز غير المتجانس عن طريق الامتزاز على السطح الصلب، حيث تلتصق جزيئات المتفاعلات على السطح أولا. وغالبا يكون امتزاز فيزيائي (ارتباط ضعيف)، ثم يحدث ارتباط بين جزيئات المواد المتفاعلة وهذا الارتباط كيميائي. حتى وإن حدث ارتباط كيميائي بين سطح المحفز والتفاعل، فعند التصاق المتفاعل الآخر به يحدث كسر للرابطة الأولى التي بين سطح المحفز والمتفاعل الأول.
طاقة التنشيط
تعرف طاقة التنشيط بأنها أقل طاقة تحتاجها المواد المتفاعلة لبدء التفاعل الكيميائي. كلما زادت هذه الطاقة زادت سرعة التفاعل، وكلما قلت قلت معها سرعة التفاعل كذلك. ويمكن التحكم في ذلك من خلال المحفزات.
خواص المحفزات
تتمتع المواد الحفازة بشكل عام بعدة خواص، منها:
- تقوم بتسريع التفاعلات الكيميائية.
- لا تستهلك أثناء التفاعل.
- كمية صغيرة منها تكفي لحفز كمية كبيرة من المتفاعلات.
- يمكن تجديدها بعد خمولها.
- تعمل بشكل متخصص، حيث أن حفازا معينا يمكن أن يحفز تفاعل معين دون غيره.
- بعضها تعمل بشكل انتقائي جدا مثل الإنزيمات. أي أنها تحفز نوع واحد فقط من التفاعلات.
- لا تغير من نقطة الاتزان في التفاعلات العكسية.
ختاماً، في هذا المنشور، تناولنا موضوع الحفز بشكل مفصل، بدءًا من تعريفه وأنواعه وخصائصه وآلية عمله.
تطرقنا إلى أهمية الحفز في الصناعات الكيميائية، وشرحنا أنواع الحفز المختلفة (المتجانس، غير المتجانس، التلقائي، الإنزيمي) مع ذكر أمثلة على كل نوع.
أخيراً ناقشنا خواص المحفزات، وكيفية عملها من خلال خفض طاقة التنشيط للتفاعل الكيميائي.
بشكل عام، يُعد الحفز موضوعًا هامًا في الكيمياء، له تطبيقات واسعة في مختلف المجالات. وفهم آلية عمل المحفزات يُساعدنا على تصميم محفزات جديدة أكثر فعالية، مما يُساهم في تطوير تقنيات جديدة وتحسين العمليات الكيميائية.
المصادر
- Taylor, H. S. (2024, March 22). catalysis. Encyclopedia Britannica.
- Prof. Maria Olean. (2009, October), Catalysts and catalytic processes and their driving forces. School of Science & Engineering. United Kingdom. (PDF file online)
- د. محمد مجدي واصل. (2004). كيمياء الحفز والسطوح. دار النشر للجامعات - مصر.
- Byjus. Catalyst.
- unacademy.com. MCQ on Catalyst and Catalysis.