سنتعرف في هذا المنشور على تصنيف و تسمية الكحولات، وتشمل طرق التسمية النظامية والشائعة مع أمثلة مختلفة. لكن قبل ذلك دعونا نعرف الكحولات أولا.
ما هي الكحولات؟
الكحولات أو الغولات هي عبارة عن مركبات عضوية تدخل في بنيتها الجزيئية مجموعة الهيدروكسيل (-OH).
ما هي الصيغة الكيميائية للكحولات؟
- تعتمد تسمية وتصنيف الكحولات على بنيتها الكيميائية.
- يمكن اعتبارها مشتقات للهيدروكربونات (R−H)، حيث يتم استبدال ذرة هيدروجين بوحدة OH−[1]، مما يجعل صيغتها R−OH، حيث R تمثل مجموعة ألكيلية[2].
- كما يمكن النظر إلى الكحولات على أنها مشتقات للماء (H−OH)، حيث استبدلت إحدى ذرتي الهيدروجين بمجموعة ألكيلية (R)، لتصبح صيغتها R−OH.
- بناءً على ما سبق، وباعتبار R=CnH2n+1 تصبح الصيغة العامة: CnH2n+1−OH. حيث n هو عدد ذرات الكربون.
تصنيف الكحولات
يتم تصنيف الكحولات تبعا لعدة عوامل وهي:
أ. تصنيف الكحولات تبعا لنوع ذرة الكربون التي تحمل المجموعة OH
تُصنف الكحولات إلى ثلاثة أنواع رئيسية بناءً على عدد ذرات الكربون المرتبطة بذرة الكربون الحاملة لمجموعة الهيدروكسيل (-OH):
الكحولات الأولية 1°: يعتبر الكحول أولي، عندما تكون ذرة الكربون الحاملة لمجموعة الهيدروكسيل مرتبطة بذرة كربون واحدة فقط، وذرتي هيدروجين، ومجموعة الهيدروكسيل نفسها.
يتم اعتبار الميثانول على أنه كحول أولي في المراجع الكيميائية بالرغم من ارتباط ذرة الكربون المتصل بالمجموعة الوظيفية بثلاث ذرات هيدروجين. ما عدا ذلك فإن الصيغة العامة لباقي الغولات الأولية هي: RCH2OH [3].
أمثلة على الكحولات الأولية:
الكحولات الثانوية 2°: هي عبارة عن مركبات تكون فيها ذرة الكربون الحاملة لمجموعة الهيدروكسيل مرتبطة بذرتي كربون أخريين، وذرة هيدروجين واحدة [4]. وتكون صيغتها، R2CHOH، حيث توجد مجموعتي ألكيل بديلة.
أمثلة على الكحولات الثانوية: 2-بروبانول، 2-بنتانول، 3-هكسانول
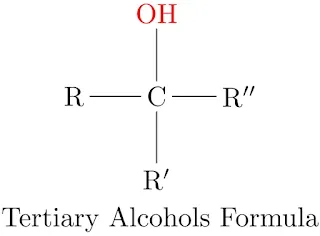
الكحولات الثالثية 3°: في هذه الكحولات يتم ارتباط ذرة الكربون الحاملة لمجموعة الهيدروكسيل بثلاث مجموعات ألكيلية. وتأخذ الصيغة، R3COH. ونلاحظ عدم ارتباط الكربون المتصل بالزمرة الوظيفية بأي ذرة هيدروجين.
أمثلة على الكحولات الثالثية: الصورة أدناه تحتوي على أشكال مختلفة للكحولات الثالثية.
ب. تصنيف الكحولات تبعا لعدد مجموعات الهيدروكسيل
يمكن تقسيم الكحولات إلى ثلاثة أقسام أو أكثر وفقا لعدد المجموعات الهيدروكسيلية الموجودة في السلسلة الهيدروكربونية.
كحولات أحادية الهيدروكسيل: وهي التي ترتبط فيها السلسلة الهيدروكربونية بمجموعة هيدروكسيلية (-OH) واحدة [3]. وعلى هذا الأساس يمكن أن نقول أن جميع الأمثلة المذكورة أعلاه تعتبر كحولات أحادية. وبالتالي الصيغة العامة لها R−OH.
كحولات ثنائية الهيدروكسيل: عندما تحتوي الكحولات على مجموعتي هيدروكسيل تسمى بالديولات [5]، أي غولات-ثنائية. وتحمل الصيغة: R(OH)2.
كحولات ثلاثية الهيدروكسيل: تسمى الكحولات المحتوية على ثلاثة مجموعات هيدروكسيلية بالترايولات [5]، أو غولات-ثلاثية. وصيغتها العامة R(OH)3.
كحولات متعددة الهيدروكسيل: الكحولات التي تحتوي على أكثر من مجموعة هيدروكسيلية تسمى بالبوليولات (Polyols)[6]. بهذا التعريف يمكن اعتبار الكحولات الثنائية والثلاثية بوليولات (عديدة الغول). وتكون الصيغة العامة للكحولات العديدة، R(OH)n، حيث n عدد مجموعات الهيدروكسيل و n≥2.
ج. يتم تصنيف الكحولات إلى أروماتية وأليفاتية:
- الكحولات الأليفاتية:
- هي التي لا تحتوي على فرع عطري (أروماتي).
- الكحولات الأروماتية:
- هي التي تحتوي على فرع عطري.
اقرأ أيضا: طرق تحضير الكحولات
تسمية الكحولات
يتم تسمية الكحولات بنظام IUPAC غالبا، ولكن هناك أيضا التسمية الشائعة، وطريقة الكربونيل وهي أقل شيوعا من سابقاتها.
تسمية الكحولات وفق قواعد الأيوبك IUPAC
يتم تسمية الكحولات البسيطة في نظام الأيوباك كمشتقات للألكان الأم باستخدام اللاحقة (-اول (-ol))، وذلك وفقا للقواعد التالية:
- القاعدة الأولى:
- تحديد أطول سلسلة كربونية متصلة بمجموعة الهيدروكسيل واعتبارها المركب الأم (الألكان) لاشتقاق الإسم منه، وزيادة المقطع (ول) لتصبح ألكانول. على سبيل المثال، بروبانول و ميثانول بدلا من بروبان و ميثان. في الإنجليزية يتم حذف حرف (e) في نهاية كلمة alkane وتضاف (ol) بسبب التقاء اثنين من حروف العلة. أما إذا توسط حرف آخر بين (ألكان) و (ول) فيتم الإبقاء على حرف (e) والذي نعتبره (ي)، كما في cis 1,4-cyclohexanediol، ونكتبه بالعربية (سيس ١،٤-سيكلوهكسانيديول).
- القاعدة الثانية:
- ترقيم سلسلة الألكان بدءا من النهاية الأقرب لمجموعة الهيدروكسيل[7]. أما في حالة ترقيم الكحولات الحلقية تعطي ذرة الكربون الحاملة لمجموعة الهيدروكسيل رقم 1 [8].
- القاعدة الثالثة:
- يتم ترقيم البدائل حسب موقعها في السلسلة وتكتب أسمائها بالترتيب الأبجدي[7] إذا كان هناك أكثر من بديل.
طريقة الترقيم: كما في الصورة أدناه يعطي الرقم 1 للطرف الأقرب إلى مجموعة OH:
ترقيم كحول حلقي: حيث نعطي ذرة كربون الزمرة رقم 1
أمثلة على أسماء الكحولات بنظام الأيوباك
يصح في نظام الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) تسمية 2-بيوتانول ب بيوتان-2-ول (Butan-2-ol). أي توسيط الرقم بين حرفي النون والواو.
لاحظ عند الميثانول لم نقل 1-ميثانول لأنه لا يوجد 2-ميثانول. وكذلك الإيثانول لانعدام 2-ايثانول (انتبه لا تخلط بينه وبين إيثان-1،2-دايول).
أمثلة أخرى تتضمن تسمية كحولات متفرعة:
ترتيب المستبدلات أبجديا في التسمية: في وجود مجموعات بديلة مختلفة (على سبيل المثال: الكلور والبروم وميثيل) هنا نذكر أولا البروم لأن الباء قبل الكاف والميم أبجديا كالتالي:
التسمية الشائعة للكحولات
في هذه الطريقة، يتم تسمية المجموعة الألكيلية أولا ثم تلحق بكلمة الكحول[1] بالإنجليزية لتصبح ألكيل ألكحول (Alkyl Alcohol). مثال Ethyl Alcohol و Methyl Alcohol. يمكن صياغتها بالعربية ب كحول ألكيل، مثال: كحول ميثيلي، كحول إيثيلي، كحول أيزو بروبيلي كحول أيزو بيوتيلي.
كلمة (أيزو - iso) تطلق على الكحولات التي تحتوي على مجموعة مثيل مرتبطة بذرة الكربون رقم 2 (2-ميثيل) بينما تشير كل من sec و tert إلى كون الكحولات ثانوية أو ثالثية على التوالي [9] وتختصر أكثر في بعض المراجع ب s و t.
مثال يتضمن كحول ذو فرع عطري
انتبه: لا تخلط بين الكحولات الأروماتية والفينولات (في الفينولات تكون مجموعة الهيدروكسيل متصلة مباشرة بحلقة البنزين).
اقرأ أيضا: تفاعلات الكحولات الكيميائية
المصادر
- أسس الكيمياء العضوية. وائل ووليد
- الكيمياء العضوية. موريسون وبويد، ترجمة صالح القادري وآخرون
- نجوى. خواص الكحولات
- RSC Secondary alcohols
- BBC. Alcohols, Types of alcohols. BITESIZE, Part of Chemistry
- Polyols, repsol
- John McMurry. (2015 print number 01). Organic Chemistry, Chapter 17. United States of America. Book. P 526
- المؤسسة العامة للتعليم الفني والتدريب المهني، الإدارة العامة لتصميم وتطوير المناهج. تقنية مختبرات كيميائية، أساسيات الكيمياء العضوية، ١٤٠ كيم. المملكة العربية السعودية. ص ٧١
- Chem.libretexts. Bookshelves. Organic Chemistry, alkanes, common names