إذا كنت داخل معمل الكيمياء أو المختبرات، وتريد القيام بتحديد تركيز عينة مجهولة التركيز بشكل دقيق عن طريق المعايرة؛ فإن أهم شيء هو معرفة الخطوات التي يجب القيام بها لتحقيق ذلك.
هنا دليل شامل سنتعرف من خلاله على خطوات المعايرة في الكيمياء؛ بدءا بإجراءات السلامة ووصولا إلى حساب النتائج. ونبين الأدوات المستخدمة والمحاليل المطلوب تحضيرها.
كما نقدم شرح وافر لكيفية إجراء حسابات المعايرة. يشمل حساب الحجم المستهلك في كل تجربة ومتوسط الحجم المستهلك للتجارب التأكيدية، حساب عدد مولات المعاير والمادة المراد إيجاد تركيزها. ونتعلم كيفية إيجاد تركيز الحليلة (العينة المراد قياسها) بوحدة مول لكل لتر (mole/L)، وبوحدة جرام لكل لتر (g/L).
المعايرة (Titration) بالتحليل الحجمي هي تقنية كيميائية تستخدم لتحديد تركيز مادة مجهولة (الحليلة) عن طريق إضافة كمية محددة من مادة معروفة التركيز(المعاير). إذا، الهدف من المعايرة هو إيجاد تركيز العينة المجهول. الشكل أدناه يوضح طريقة إعداد أدوات المعايرة.
خطوات المعايرة بالتحليل الحجمي
- احتياطات السلامة:
- سواء كنت مبتدئا أو خبيرا يجب أن تكون قد قرأت اللائحة المعملية لإجراءات السلامة.
- إذا كنت مبتدئا يجب أن تعمل تحت اشراف المشرف.
- ارتد نظارات وقفازات السلامة لحماية نفسك من المواد الكيميائية.
- كن حذرا عند التعامل مع المحاليل المركزة.
- التخلص من النفايات الكيميائية بشكل صحيح.
اقرأ المقالة الأساسية: إجراءات السلامة في مختبر الكيمياء: مخاطر المواد والمعدات والحوادث
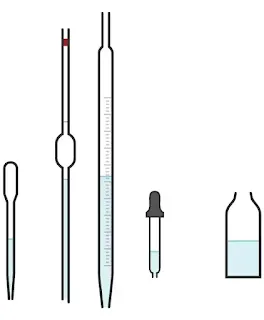
- تجهيز الأدوات المستخدمة (المعدات)
- السحاحة (أنبوب زجاجي طويل متدرج مع محبس).
- دورق مخروطي (Erlenmeyer flask)
- ماصة (أنبوب زجاجي رفيع يستخدم لنقل كمية محددة من السائل).
- دورق حجمي (يستخدم لتحضير محلول معروف التركيز)
- محلول الكاشف أو الدليل (مادة يتغير لونها عند نقطة التكافؤ)
- زجاجة غسيل (مملوءة بالماء المقطر)
- ورق أبيض (للمساعدة في تصور تغير اللون).
- قمع مخروطي زجاجي أو بلاستيكي.
- حامل معدني لتثبيت السحاحة.
تعرف على القائمة الكاملة ل الأواني الزجاجية والأدوات المستخدمة في معمل الكيمياء
- السحاحة (أنبوب زجاجي طويل متدرج مع محبس).
- تنظيف المعدات:
- نظف السحاحة والماصة والدورق المخروطي والأدوات اللازمة الأخرى بالماء المقطر لإزالة أي شوائب.
- جفف هذه الأدوات في الهواء الخالي من الغبار أو باستخدام المجفف، حتى لا يبقى فيها أي أثر لجزيئات الماء المقطر.
- تجهيز المحاليل
- قم بإعداد المحلول المعاير بالتركيز المطلوب.
- خذ كمية مناسبة من هذا المحلول في كأس نظيف وجاف.
- اشفط السحاحة بمحلول المعاير.
إعداد المعاير:
- قياس حجم الحليلة المطلوب باستخدام ماصة.
- صب الحليلة في دورق مخروطي.
إعداد الحليلة:
- أضف بضع قطرات من الدليل إلى الحليلة.
- رج الدورق المخروطي برفق.
إضافة الدليل:
اقرأ أيضا: أدلة معايرات التعادل: اختيار كاشف معايرة الحمض مع القاعدة المناسب
- إعداد السحاحة:
- ثبِّت السحاحة على الحامل.
- ضع قمع نظيف وجاف على السحاحة.
- أغلق المحبس(الصمام) بشكل محكم.
- املأ السحاحة بمحلول المعاير من الكأس الزجاجي.
- ابدأ المعايرة
- ضع دورق مخروطي يحتوي على المادة التحليلية تحت السحاحة.
- افتح محبس السحاحة ببطء للسماح للمحلول بالتدفق إلى الحليلة.
- قم بتحريك الدورق باستمرار لضمان الخلط السليم.
- الاقتراب من نقطة النهاية
- عندما تقترب من نقطة النهاية (النقطة التي يكتمل عندها التفاعل)، سيبدأ لون المحلول الموجود في الدورق بالتغير.
- أبطئ عملية إضافة محلول المعايرة ولاحظ تغير اللون بعناية.
- الوصول إلى نقطة النهاية
- يتم الوصول إلى نقطة النهاية عندما يتغير لون المؤشر بالكامل ويظل ثابتًا لمدة 30 ثانية على الأقل.
- سجل حجم محلول المعاير المضاف عند هذه النقطة.
- كرر المعايرة: قم بإجراء معايرتين إضافيتين على الأقل لضمان الدقة والإحكام.
- احسب النتائج: استخدم حجم محلول المعاير المستخدم والتركيز المعروف للمحلول لحساب تركيز المادة التحليلية. سيعتمد الحساب على نوع المعايرة المحدد الذي يتم إجراؤه.
تسجيل النتائج وإجراء الحسابات
تحديد حجم التجربة: لإيجاد الحجم يكون لدينا حجمين نطرحهما من بعضهما للحصول الحجم المستهلك.
- الحجم الأول (الابتدائي): هو الحجم بعد ملء السحاحة؛ أي حجم السحاحة. يجب أن نملاؤه إلى نقطة الصفر بالأعلى. ويجب أن تعرف حجم السحاحة هل هي 25 مل؟ أو غير. وأيا كان فيعتبر الحجم الأول.
- الحجم الأخير (النهائي): وهو الحجم عند نقطة النهاية (نقوم بإيقاف المعايرة ونقرأ التدريج المحاذي لحجم المحلول في السحاحة).
- الحجم المستهلك: وهو الحجم المطلوب تحديده من خلال المعايرة. ويمكن إيجاده من المعادلة التالية:
قم بعمل جدول على ورقة لتسجيل نتائج المعايرة كالتالي:
| التجربة | الحجم المستهلك من السحاحة (سم٣) |
|---|---|
| التجربة الأولى | --- |
| التجربة الثانية | --- |
| التجربة الثالثة | --- |
| متوسط الحجم | --- |
حساب عدد مولات المعاير
ثم نقوم باستخدام العلاقة بين عدد المولات والتركيز والحجم لإيجاد عدد مولات المعاير (معلوم التركيز والحجم(متوسط الحجم)). وهذه العلاقة هي أهم قانون في المعايرة، ويأخذ الصيغة التالية:
n = C \cdot V
حيث:
- n عدد مولات المعاير.
- C تركيز المعاير (مول/لتر).
- V متوسط الحجم للمعاير باللتر.
وغالبا ما يكون الحجم بالمللي ( \text{ml} ) ويمكن تحويله إلى لتر وذلك بالقسمة على 1000، كما يلي:
V(\text{ml}) \times \frac{1\ \text{L}}{1000\ \text{ml}} = V(\text{L})
على سبيل المثال: إذا كان متوسط الحجم 15\ \text{ml} ، نقوم بتحويله كما يلي:
\require{cancel}15\ \cancel{\text{ml}} \times \frac{1\ \text{L}}{1000\ \cancel{\text{ml}}} = 0.015\ \text{L}
حساب عدد مولات الحليلة
الآن أول خطوة في إيجاد التركيز المجهول هو كتابة المعادلة الموزونة.
\ce{aA + bB <=> cC + dD}
حيث a و b و c و d عدد جزيئات أو أيونات \ce{A} و \ce{B} و \ce{C} و \ce{D} المشاركة في التفاعل على التوالي.
من المعادلة الموزونة أعلاه ولو افترضنا أن الحليلة هي: \ce{B} ، نحسب عدد مولات الحليلة (العينة) من خلال العلاقة التالية:
b \cdot n_{(\ce{B})} = a \cdot n_{(\ce{A})} \therefore n_{(\ce{B})} = \frac{a \cdot n_{(\ce{A})}}{b}
حيث:
- n_{(\ce{A})} عدد مولات المعاير \ce{A} ، التي قمنا بإيجادها سابقا.
- n_{(\ce{B})} عدد مولات الحليلة \ce{B} ، التي نريد إيجادها الآن من العلاقة أعلاه.
- و b و a تم تعريفها أعلاه، وهي من المعادلة الموزونة.
- C التركيز المولي للحليلة.
- V حجم الحليلة.
اقرأ أيضا: المعايرة: أربعة أنواع رئيسية من المعايرات
ملاحظات
- من المهم استخدام دليل مناسب لنوع المعايرة التي يتم إجراؤها.
- يجب إجراء المعايرة في مكان مظلم قليلا (إطفئ المصابيح القريبة) لضمان رؤية تغير اللون بشكل صحيح.
- يجب تسجيل حجم محلول المعايرة المستخدم بدقة لضمان نتائج دقيقة.
- انتبه إلى درجة الحرارة: يمكن أن تؤثر التغيرات في درجة الحرارة على حجم المحاليل ودقة المعايرة.
خاتمة:
المعايرة بالتحليل الحجمي هي تقنية قوية يمكن استخدامها في مجموعة متنوعة من التطبيقات، بما في ذلك تحليل المواد الكيميائية والبيئية والطبية. مع الممارسة، يمكن للطلاب والعلماء أن يصبحوا ماهرين في إجراء المعايرات بالتحليل الحجمي بدقة وكفاءة.