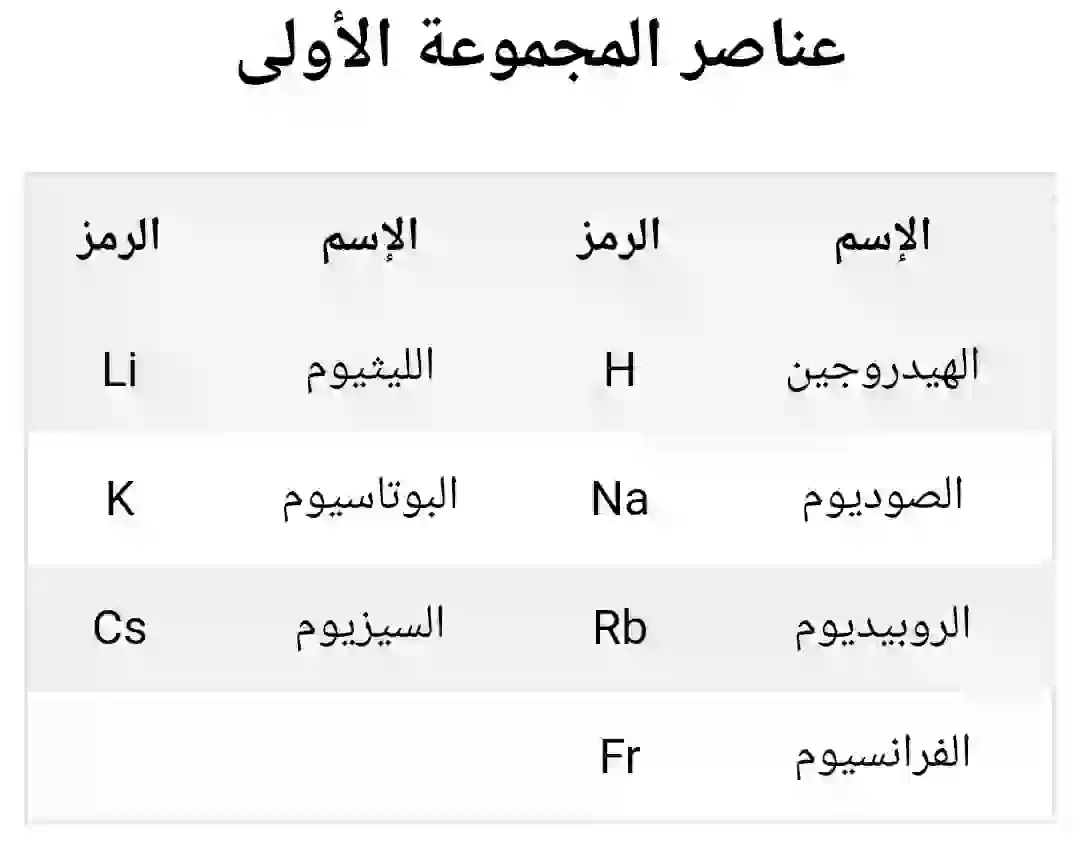
المجموعة الأولى (الفلزات القلوية):
تعتبر المجموعة الأولى (المجموعة: 1 أو 1A أو IA) في الجدول الدوري من المجموعات الهامة والمثيرة للاهتمام من العناصر الكيميائية، والتي تسمى ب "الفلزات القلوية" باستثناء الهيدروجين.
تضم هذه المجموعة عدد من العناصر التي تشترك في خواص كيميائية معينة مثل النشاط الكيميائي العالي، وتظهر ترتيبًا معينًا وفقًا للعدد الذري. سنستكشف في هذا المقال بعض العناصر الرئيسية في هذه المجموعة ونسلط الضوء على بنيتها الذرية وخصائصها الكيميائية المميزة.
تشمل المجموعة الأولى الهيدروجين، والليثيوم، والصوديوم، والبوتاسيوم، والروبيديوم، والسيزيوم، والفرانسيوم. على الرغم من تنوع هذه العناصر من حيث الخصائص والاستخدامات، إلا أنها تشترك في بعض السمات الجوهرية نظرا لوقوعها في نفس المجموعة من الجدول الدوري. سنناقش كل عنصر بالتفصيل ونلقي نظرة على توزيع الإلكترونات والبنية الذرية لكل منها.
فهم بنية هذه العناصر يساعدنا في التعرف على سبب تفاعلها مع العناصر الأخرى وتشكيل مركبات جديدة. بالإضافة إلى ذلك، سنلقي نظرة على بعض الاستخدامات الشائعة لهذه العناصر في مختلف المجالات، سواء في الصناعة أو الطب أو البحث العلمي.
انضم إلينا في هذه الرحلة لاكتشاف عناصر المجموعة الأولى في الجدول الدوري؛ التركيب والخصائص الكيميائية وكيفية تأثيرها على حياتنا اليومية والعلم بشكل عام.
أهمية الفلزات القلوية
التركيب الذري لعناصر المجموعة الأولى
-
الهيدروجين (H):
- عدد الذري: 1
- العدد الكتلي: 1.00784
- عدد البروتونات: 1
- عدد النيوترونات: 0
- عدد الإلكترونات: 1
- توزيع الإلكترونات: 1s¹
- الليثيوم (Li):
- عدد الذري: 3
- العدد الكتلي: 6.938
- عدد البروتونات: 3
- عدد النيوترونات: 4
- عدد الإلكترونات: 3
- توزيع الإلكترونات: 1s² 2s¹
-
الصوديوم (Na):
- عدد الذري: 11
- العدد الكتلي: 22.989
- عدد البروتونات: 11
- عدد النيوترونات: 12
- عدد الإلكترونات: 11
- توزيع الإلكترونات: 1s² 2s² 2p⁶ 3s¹
-
البوتاسيوم (K):
- عدد الذري: 19
- العدد الكتلي: 39.098
- عدد البروتونات: 19
- عدد النيوترونات: 20
- عدد الإلكترونات: 19
- توزيع الإلكترونات: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
-
الروبيديوم (Rb):
- عدد الذري: 37
- العدد الكتلي: 85.468
- عدد البروتونات: 37 (للنظير الأكثر شيوعًا)
- عدد النيوترونات: 48
- عدد الإلكترونات: 37
- توزيع الإلكترونات: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s¹
-
السيزيوم (Cs):
- عدد الذري: 55
- العدد الكتلي: 132.905
- عدد البروتونات: 55
- عدد النيوترونات: 78
- عدد الإلكترونات: 55
- توزيع الإلكترونات: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s² 4d¹⁰ 5p⁶ 6s¹
-
الفرانسيوم (Fr):
- عدد الذري: 87
- الكتلة الذرية: 223.0197
- عدد البروتونات: 87
- عدد النيوترونات: 136 (لأكثر النظائر استقرارًا)
- عدد الإلكترونات: 87
- توزيع الإلكترونات: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s² 4d¹⁰ 5p⁶ 6s² 4f¹⁴ 5d¹⁰ 6p⁶ 7s¹
الخصائص الكيميائية والفيزيائية
- نقطة انصهار منخفضة: تتميز الفلزات القلوية بنقاط انصهار منخفضة، مما يعني أنها تنصهر بسهولة عند درجات حرارة منخفضة نسبياً. على سبيل المثال، نقطة انصهار الليثيوم تقدر بحوالي 180 درجة مئوية، ونقطة انصهار الصوديوم تقدر بحوالي 98 درجة مئوية.
- قابلية التوصيل الحراري والكهربائي: تتميز الفلزات القلوية بقدرتها العالية على توصيل الحرارة والكهرباء. يترتب على ذلك استخدامها في العديد من التطبيقات الكهربائية والإلكترونية.
- قوة ميكانيكية ضعيفة: على الرغم من أن الفلزات القلوية لديها قوة ميكانيكية ضعيفة، إلا أنها تظهر تمددًا حراريًا عاليًا. وهذا يعني أنها قادرة على التمدد والانكماش بشكل كبير عند تعرضها لتغيرات في درجات الحرارة.
- تفاعلية كيميائياً: تتفاعل الفلزات القلوية بسهولة مع الماء والأكسجين في الهواء، مما يؤدي إلى تكوين المركبات القلوية. وتتفاعل أيضًا مع الأحماض لتشكيل الملح وإطلاق الهيدروجين.
- كثافة منخفضة: تتميز الفلزات القلوية بكثافة منخفضة، حيث تكون أخف وزنًا من العديد من الفلزات الأخرى. على سبيل المثال، الليثيوم لديه كثافة تقدر بحوالي 0.5 جم/سم³، بينما الصوديوم لديه كثافة تقدر بحوالي 0.97 جم/سم³.
هذه بعض الخواص الفيزيائية الرئيسية للفلزات القلوية، وتوضح بعض الخصائص المميزة التي تميز هذه العناصر في الحالة الصلبة.
التفاعلات الكيميائية لعناصر المجموعة الأولى
باستثناء الهيدروجين، جميع هذه العناصر فلزات قلوية نشطة كيميائيًا، وتزداد نشاطيتها كلما نزلنا في المجموعة.
1. التفاعل مع الماء
تتفاعل الفلزات القلوية مع الماء بقوة متزايدة من الليثيوم إلى السيزيوم، منتجةً هيدروكسيد الفلز والهيدروجين، مما يجعل المحلول قاعديًا:
2M + 2H_2O \rightarrow 2MOH + H_2 \uparrow حيث M يمثل الفلز القلوي.
أمثلة:
- الليثيوم: \ce{2Li + 2H2O -> 2LiOH + H2}
- الصوديوم: \ce{2Na + 2H2O -> 2NaOH + H2}
- البوتاسيوم: \ce{2K + 2H2O -> 2KOH + H2}
2. التفاعل مع الأكسجين
تُكوِّن الفلزات القلوية أكاسيد أو بيروكسيدات أو فوق الأكاسيد عند تعرضها للهواء.
- الليثيوم: \ce{4Li + O2 -> 2Li2O}
- الصوديوم: \ce{2Na + O2 -> Na2O2}
- البوتاسيوم: \ce{K + O2 -> KO2} (فوق أكسيد البوتاسيوم)
3. التفاعل مع الهالوجينات
تتفاعل الفلزات القلوية بقوة مع الهالوجينات (F2, Cl2, Br2, I2) مكونة أملاح الهاليدات:
2M + X_2 \rightarrow 2MX حيث X يمثل الهالوجين.
- الصوديوم + الكلور: \ce{2Na + Cl2 -> 2NaCl}
- البوتاسيوم + البروم: \ce{2K + Br2 -> 2KBr}
4. التفاعل مع الهيدروجين
تتفاعل الفلزات القلوية مع الهيدروجين عند درجات حرارة عالية مكونة هيدريدات الفلزات:
2M + H_2 \rightarrow 2MH
- الصوديوم + الهيدروجين: \ce{2Na + H2 -> 2NaH}
5. التفاعل مع الكبريت
تتفاعل الفلزات القلوية مع الكبريت مكونة كبريتيدات الفلزات:
2M + S \rightarrow M_2S
- الصوديوم + الكبريت: \ce{2Na + S -> Na2S}
6. التفاعل مع النيتروجين (خاص بالليثيوم)
الليثيوم هو الفلز القلوي الوحيد الذي يتفاعل مع النيتروجين مباشرة، مكونًا نيتريد الليثيوم:
6Li + N_2 \rightarrow 2Li_3N
يمكن وصف تفاعلية الفلزات القلوية في النقاط التالية:
- تزداد النشاطية الكيميائية نزولًا في المجموعة.
- تتفاعل الفلزات القلوية بقوة مع الماء، الأكسجين، الهالوجينات، الهيدروجين، الكبريت.
- الليثيوم يتفاعل مع النيتروجين، وهو استثناء بين الفلزات القلوية.
- السيزيوم والروبيديوم شديدا التفاعل، وقد يسببان انفجارات عند ملامسة الماء أو الهواء.
مركبات عناصر المجموعة الأولى
بسبب النشاط الكيميائي المتزايد لهذه العناصر، لا يمكن الحصول عليها منفردة، بل تتحد مع عناصر كيميائية أخرى لتكوين مركبات متنوعة. ولذلك يتم حفظها داخل الزيوت حتى لا تتفاعل مع الهواء والرطوبة. أثناء تكوين المركبات، تتأيّن الفلزات القلوية عن طريق فقدان الإلكترون الوحيد الموجود في الغلاف الخارجي لها لتتحول إلى أيونات موجبة أحادية التكافؤ (+1).
1. هيدروكسيدات الفلزات القلوية (القواعد القوية)
عند تفاعل الفلزات القلوية مع الماء، تتشكل هيدروكسيدات الفلزات القلوية، وهي مركبات ذات طبيعة قاعدية قوية، مثل:
- هيدروكسيد الصوديوم (NaOH)، المعروف بالصودا الكاوية، ويستخدم في صناعة الصابون والورق والمنظفات.
- هيدروكسيد البوتاسيوم (KOH)، الذي يُستخدم في صناعة البطاريات القلوية وصناعة الزجاج.
2. أكاسيد الفلزات القلوية
عند احتراق الفلزات القلوية في الهواء، تتفاعل مع الأكسجين مكوّنة أكاسيد، مثل:
- أكسيد الليثيوم (Li₂O)، الذي يُستخدم في صناعة الزجاج والسيراميك.
- أكسيد الصوديوم (Na₂O)، الذي يدخل في تصنيع الزجاج المقاوم للحرارة.
بعض الفلزات القلوية، مثل الصوديوم والبوتاسيوم، تشكل فوق الأكاسيد (Na₂O₂، K₂O₂) أو الأوزونيدات (KO₃)، والتي تُستخدم في التطبيقات الكيميائية المتقدمة.
3. هاليدات الفلزات القلوية (الأملاح القابلة للذوبان)
تتفاعل الفلزات القلوية بسهولة مع الهالوجينات (الكلور، الفلور، البروم، اليود) لتكوين هاليدات الفلزات القلوية، مثل:
- كلوريد الصوديوم (NaCl)، المعروف بملح الطعام، وهو أحد أكثر المركبات انتشارًا في الطبيعة.
- فلوريد الليثيوم (LiF)، الذي يستخدم في صناعة الزجاج والبصريات.
4. الكربونات والسلفات والفوسفات
تلعب مركبات الفلزات القلوية الأخرى دورًا مهمًا في عدة مجالات، ومنها:
- كربونات الليثيوم (Li₂CO₃)، التي تُستخدم في بطاريات الليثيوم أيون وفي علاج الاضطرابات النفسية.
- سلفات البوتاسيوم (K₂SO₄)، وهي سماد زراعي غني بالبوتاسيوم.
- فوسفات الصوديوم (Na₃PO₄)، التي تدخل في صناعة المنظفات ومعالجة المياه.
استخدامات عناصر المجموعة الأولى في المجالات المتعددة
التطبيقات الصناعية:
تتميز عناصر المجموعة الأولى بتطبيقات صناعية متنوعة. يستخدم الهيدروجين في تصنيع الأمونيا والزيت النباتي المهدرج. الصوديوم والبوتاسيوم يستخدمان في صناعة الصابون والمنظفات، بالإضافة إلى تحضير مركبات كيميائية أساسية.
التطبيقات البيولوجية والطبية:
البوتاسيوم والصوديوم أمثلة على العناصر التي تلعب دورًا هامًا في التوازن الكهربائي للخلايا والأنسجة في الجسم البشري. يعتبر البوتاسيوم ضروريًا لوظائف العضلات والأعصاب، في حين يسهم الصوديوم في تنظيم ضغط الدم والتوازن الحمضي-القاعدي في الدم.
التطبيقات الزراعية:
يُستخدم البوتاسيوم كعنصر أساسي في الأسمدة الزراعية لتحسين نمو النباتات وزيادة إنتاج المحاصيل. تعزز هذه الأسمدة من صحة النباتات وتقويتها لمقاومة الأمراض والظروف البيئية القاسية.
التطبيقات التكنولوجية:
الليثيوم يتمتع بتطبيقات تكنولوجية مهمة، حيث يُستخدم في بطاريات الليثيوم أيون التي تُستخدم في الهواتف الذكية وأجهزة اللابتوب وسيارات الكهرباء. كما يُستخدم في مجال التكنولوجيا النووية والمصابيح الخفيفة.
التطبيقات الفضائية:
يتم استخدام الهيدروجين كوقود في محركات الصواريخ الفضائية، حيث يتفاعل مع الأكسجين لتوليد طاقة دافع قوية. هذا يساهم في تحقيق الانطلاقات الفضائية واستكشاف الفضاء الخارجي.
التطبيقات البيئية:
تستخدم مركبات الصوديوم والبوتاسيوم في معالجة المياه لتنقيتها وتحسين جودتها. كما يُستخدم الصوديوم في عمليات إزالة الجليد عن الطرق خلال فصل الشتاء.
التطبيقات البحثية والتكنولوجية المتقدمة:
السيزيوم يُستخدم في الأبحاث العلمية والتطبيقات التكنولوجية المتقدمة مثل التقنيات البصرية وتقنيات اختبار الأجهزة الطبية.
إن عناصر المجموعة الأولى تتمتع بتطبيقات متعددة تغطي مجموعة واسعة من المجالات، مما يعكس أهميتها في التقدم التكنولوجي والتنمية الاقتصادية والاستدامة البيئية.
الأسئلة الشائعة
ما هي عناصر المجموعة الأولى في الجدول الدوري؟
المجموعة الأولى تشمل الهيدروجين وعناصر القلويات القلوية: الليثيوم، الصوديوم، البوتاسيوم، الروبيديوم، السيزيوم، والفرانسيوم.
ما هي الخصائص العامة لعناصر المجموعة الأولى؟
تشتمل على عناصر فلزية قلوية تكون عادةً متفاعلة مع الماء والهالوجينات. لديها عدد كتلي وذري منخفض، وهي مشتركة في تفاعلات كيميائية مع عناصر أخرى.
ما هي استخدامات الهيدروجين في المجالات المختلفة؟
يُستخدم في تصنيع الأمونيا، صناعة الزيت النباتي المهدرج، وكوقود لمحركات الصواريخ الفضائية.
ماذا ينتج عن تفاعل الليثيوم مع الماء والهالوجينات؟
يتفاعل مع الماء لتكوين هيدروكسيد الليثيوم وغاز الهيدروجين، ومع الهالوجينات لتكوين مركبات مثل كلوريد الليثيوم.
ما هي التطبيقات الطبية للبوتاسيوم والصوديوم؟
يساهمان في تنظيم التوازن الكهربائي للخلايا والأنسجة في الجسم، ويسهمان في وظائف العضلات والأعصاب وتنظيم ضغط الدم.
ما هي استخدامات البوتاسيوم في مجال الزراعة؟
يُستخدم في الأسمدة الزراعية لتحسين نمو النباتات وزيادة إنتاج المحاصيل.
ما هي نواتج تفاعل الهيدروجين مع الأكسجين؟
تفاعل الهيدروجين مع الأكسجين ينتج عنه ماء (H₂O) وإطلاق طاقة حرارية.