في هذه المقالة سنتعرف على الكهروسالبية والعوامل المؤثرة في زيادتها. والعلاقة بينها وبين نوع الرابطة والقطبية، واتجاه زيادة ونقصان الكهرسلبية خلال الجدول الدوري. بالإضافة إلى أهميتها والفرق بينها وبين الكهروموجبية.
كما يشتمل هذا الشرح على بعض مقاييس الكهروسالبية المشهورة. وكيفية تأثير هذه الخاصية على السلوك الكيميائي للذرات.
ما هي الكهرسلبية؟
هي مقياس لقدرة الذرات على جذب زوج من الإلكترونات المشتركة في الرابطة الكيميائية داخل الجزيء، وليس لها بُعد[1]. هناك عدد من المقاييس لكن مقياس بولينج ومقياس مولكين من أكثرها شهرة لقياس السالبية الكهربائية [2]. الفلور هو العنصر الأكثر كهرسلبية بينما السيزيوم الأقل في الكهرسلبية.
تشير كلمة "الكهرسلبية" إلى قدرة الذرات على جذب الإلكترونات في الروابط الكيميائية، وتختلف المواد في قدرتها على جذب الإلكترونات. فكلما زادت قيمة الكهرسلبية، زادت قدرة المادة على جذب الإلكترونات.
في الذرات التي تمتلك قيمة عالية في الكهرسلبية، نجد أنها تتمسك بقوة بإلكتروناتها في الغلاف الأخير (غلاف التكافؤ) الذي يمكن انتزاع الإلكترونات منه. وعلى العكس، نجد أن الذرات ذات الكهرسلبية المنخفضة تتخلى عن إلكتروناتها بسهولة، وذلك بسبب ضعف تمسك تلك الإلكترونات بالنواة.
ويترتب هذا الضعف إما نتيجة لقلة عدد الإلكترونات في الغلاف الخارجي، مما يجعل القيمة الإجمالية للشحنة السالبة في هذا المدار قليلة، حيث لا يرتبط هذا الغلاف بالنواة بشدة. أو ينتج هذا الضعف من زيادة عدد المدارات وابتعاد الغلاف الأخير عن النواة، مما يسهل من نزع إلكترون من هذا الغلاف. وعندما يتجمع السببان المذكوران في ذرة واحدة، فإنها ستكون ذات كهرسلبية منخفضة جدًا.
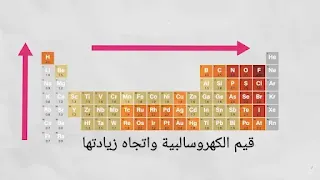
وبإلقاء نظرة على الجدول الدوري مع الأخذ بعين الاعتبار كلا من اتجاه زيادة عدد الإلكترونات واتجاه زيادة عدد الأغلفة، نلاحظ بوضوح سبب زيادة الكهرسلبية في الفلور وقلتها في السيزيوم والفرنسيوم.
كيف تزداد الكهروسالبية في الدورة الأفقية في الجدول الدوري؟
عندما نتحرك خلال فترة(دورة) من اليسار إلى اليمين، تزداد الشحنة النووية ويقل الحجم الذري، وبالتالي تزداد قيمة الكهروسلبية عبر فترة في الجدول الدوري الحديث. على سبيل المثال، يتم توضيح اتجاه زيادة هذه الخاصية خلال الدورة الثالثة في كما يلي.
كيف تزداد السالبية الكهربائية خلال المجموعات الرأسية؟
يزداد العدد الذري خلال الجدول الدوري عندما ننتقل إلى الأسفل داخل المجموعة الرأسية. يصاحب ذلك زيادة في الشحنة النووية(الموجبة). ولكن لا يؤدي ذلك إلى الزيادة في السالبية الكهربية بسبب زيادة عدد الأغلفة كلما اتجهنا لأسفل. بناء على ذلك ستنخفض الكهروسالبية كلما نزلنا إلى أسفل المجموعة الواحدة.
ففي الهالوجينات مثلا: نجد الفلور F، في أعلى المجموعة وهو يمتلك أعلى كهروسالبة. بينما عنصر الاستاتين At، الذي يقع في أسفل مجموعة الهالوجينات يمتلك أقل قيمة في الكهروسلبية من بين عناصر مجموعته. كما في المخطط التالي:
- زيادة الحجم الذري يؤدي إلى انخفاض قيمة الكهروسلبية.
- يزداد السالبية الكهربية من اليسار إلى اليمين خلال الدورة الأفقية في الجدول الدوري.
- تقل الكهروسلبية من الأعلى إلى الأسفل خلال المجموعة الواحدة.
| العوامل | التأثير |
|---|---|
| حجم الذرة | مع زيادة حجم الذرة يبتعد إلكترونات الغلاف الأخير للذرة عن النواة؛ هذه يؤدي إلى قوة جذب أقل بينها وبين النواة. وكما أسلفنا فإن ذلك سيقلل من قيمة السالبية الكهربية. |
| شحنة النواة | يزداد قيمة السالبية الكهربية بزيادة شحنة النواة. وسبب هذه الزيادة هو أنه كلما زادت قيمة الشحنة النووية زادت معها قوة الجذب بين النواة وإلكترونات الغلاف الأخير. |
| تأثير الذرة البديلة | تتغير قيمة كهرسلبية الذرة حسب البديل الذي ترتبط به. فمثلا تكتسب ذرة الكربون في مركب CF3I، شحنة موجبة أكبر من التي في المركب CHI. ولذلك فإن ذرة الكربون الموجودة في CF3I، لها سالبية كهربية أكبر مقارنة بالمركب CH3I. هذا الإختلاف في الكهرسلبية الناتج عن إختلاف البديل ينتج عنه سلوك كيميائي مختلف للعنصر. |
| كثافة الإلكترون الذري | كثافة الإلكترون الذري هي مقياس لعدد الإلكترونات الموجودة في الغلاف الأخير للذرة. كلما زادت كثافة الإلكترون الذري زادت قوة جذب النواة للإلكترونات. |
| حالة الأكسدة | حالة الأكسدة للعنصر تؤثر أيضًا على الكهروسالبية الناقصة. فالعناصر في حالات الأكسدة الأعلى لها كهرسالبية ناقصة أكبر من العناصر في حالات الأكسدة الأقل. |
تأثير الكهروسلبية على السلوك الكيميائي للذرات
تأثير الكهروسلبية على الروابط الكيميائية
التأثير على الخصائص الكيميائية للمواد
المواد التي تمتلك روابط تساهمية غير قطبية، لا تتفاعل في الغالب بسبب تأثير الشحنة فهي أكثر مقاومة للتفاعلات الكيميائية. مثال على ذلك الألكانات، فهي تتكون من الكربون والهيدروجين المتقاربتين جدا في السالبية الكهربائية. لذا فإن التفاعلات الكيميائية للألكانات قليلة.
أما المركبات القطبية بسبب وجود الشحنة الجزئية على أطراف الرابطة فهي تتعرض بسهولة لهجمات الإلكترفيلات أو النيوكلوفيلات، لذلك فهي أكثر تفاعلا من النوع السابق. المواد الأكثر تفاعلا بسبب الشحنة الكهربية هي المركبات التي تحتوي على روابط أيونية. فهي مركبات غير عضوية كما في التفاعلات بين الفلزات القلوية والهالوجينات.
السالبية الكهربية والرابطة الأيونية والتساهمية:
من خلال الكهروسالبية يمكن تحديد نوع الرابطة الكيميائية. فمثلا؛ إذا كان الفرق في السالبية الكهربية أكبر من 1.7 فإن نوع الرابطة ستكون أيونية. أما إذا كان الفرق بين 0.4 و 1.7 فإن الرابطة ستكون تساهمية، وهكذا نستطيع توقع متى تكون الرابطة أيونية.
ملحوظة: تتكون الرابطة التساهمية إذا كان الفرق في السالبية الكهربية قليلا. وإذا كان الفرق كبيرا ستتكون الرابطة الأيونية، وتتمتع الروابط التساهمية بشيء من الأيونية والعكس صحيح. وكما أن فرق السالبية الكهربائية في الذرات المتماثلة تكون صفرا مثل؛ رابطة(C-C).
القطبية والسالبية الكهربية:
أما إذا كان الفرق في الكهروسلبية قليلا(بين 0.4 و 1.7) عندها تسمى الرابطة تساهمية قطبية.
أهمية الكهرسلبية
تكمن أهمية السالبية الكهربائية في أنها من الخصائص الكيميائية التي تمدنا بمعلومات مهمة جدا حول سلوك الذرة في التفاعلات الكيميائية. حيث أنها تعطي معلومات عن نوع الرابطة الكيميائية الناشئة عن التفاعل الكيميائي.
تستخدم قيم الكهروسلبية في تحديد أعداد الأكسدة في الحالات التي يصعب فيها تحديد أي ذرة تأخذ قيمة موجبة وأيهما تأخذ قيمة سالبة. حيث يتم اعتبار الذرة التي تمتلك قيمة أقل في الكهروسلبية بأنها موجبة[6].
الفرق بين الكهروسالبية و الكهروموجبية
يعتبر الموجبية الكهربية عكس السالبية الكهربية. تزداد الموجبية بزيادة الحجم الذري في المجموعة وتقل من اليسار إلى اليمين في الجدول الدوري. وتعتبر السيزيوم والفرنسيوم أكثر العناصر حساسية للكهرباء(لها أكبر قيمة كهرموجبية).
ويمكن تعريف الموجبية الكهربية بأنها مقياس لقدرة الذرات على فقد الإلكترونات(التبرع بالإلكترونات). تزداد قيمة الكهروموجبية في المعادن. ونجد أن المعادن ذوات الحجم الكبيرة التي تمتلك إلكترون واحد في الغلاف الأخير؛ تمتلك قيمة أعلى في الموجبية الكهربية بسبب سهولة تخليها عن الإلكترون البعيد عن النواة.
على العكس، نجد أن اللافلزات وخاصة الموجودة في المجموعة السابعة تمتلك أقل قيمة في الكهرموجبية. يحدث هذا بسبب وجود سبعة إلكترونات في الغلاف الأخير والتي تتشبث بها النواة بقوة. هذا الجذب بقوة يقلل من حجم الذرة ويصعب انتزاع الإلكترونات.
تحديد نوع الرابطة بحساب الفرق في الكهروسالبية
حساب الفرق في الكهروسلبية في مركب أو جزيء معين يخبرنا عن نوع الرابطة التي تربط بين ذراته. افتح الصورة أدناه لمعرفة قيم الكهروسالبية لكل عنصر.
إيجاد الفرق في الكهروسلبية
مثلا: مركب فلوريد الهيدروجين (HF)، يتكون من ذرة الفلور (F) التي تمتلك كهروسالبية قيمتها 4.0 وذرة الهيدروجين (H) ذات كهروسالبية قيمتها 2.1 يمكننا إيجاد الفرق الذي يحدد نوع الرابطة كالتالي:
∆EN = ∆ENF - ∆ENH
∆EN = 4.0 - 2.1 = 1.9
تحديد الرابطة التساهمية غير القطبية
في جزيئات مثل O2 ستكون الفرق في الكهروسلبية صفر وذلك بسبب تماثل الذرات.
أي أن قيمة كهروسلبية الاوكسجين هو 3.5 وعندما نطرح منها نفس القيمة سنحصل على صفر.
∆EN = 0
وما دام أن قيمة الرابطة أقل من 0.5 فإن نوع الرابطة تساهمية غير قطبية.
الروابط التي لديها فرق في الكهروسالبية صفر أو قريبة من الصفر تحتاج إلى كمية كبيرة من الطاقة لكسرها. لأنها لا تحتوي على شحنة تسبب الانجذاب نحو الذرات الأخرى.
تحديد الرابطة التساهمية القطبية
في حزيء الماء H2O الذي يحتوي على ذرتي هيدروجين وذرة أكسجين واحدة؛ فإن الفرق في الكهروسلبية بين الهيدروجين والأكسجين يمكن إيجادها كالتالي:
∆EN = 3.5 - 2.1 = 1.4
إذا الفرق في الكهروسلبية هو 1.4 وهذه القيمة أقل من 1.7 وأكبر من 0.5. وبالتالي فإن نوع الرابطة تساهمية قطبية.
تحديد الرابطة الأيونية
مثال آخر للرابطة الايونية، في ملح كلوريد الصوديوم فإن نوع الرابطة الموجودة بين ذرتيه أيونية. دعونا نأكد ذلك بالحسابات الرياضة؛ يمتلك الكلور قيمة كهروسلبية مقدارها 3، في حين أن كهروسالبة الصوديوم 0.9. لذلك يتم حساب الفرق كما يلي:
∆EN = 3 - 0.9 = 2.1
إذا الفرق اكبر من 1.7 وبالتالي نوع الرابطة أيونية. يمكن كسر مثل هذه الروابط عبر الروابط التساهمية القطبية. مثلا هذا المركب وهو كلوريد الصوديوم يذوب في الماء[3].
مقياس السالبية الكهربائية
بعد أن ظهر مفهوم الكهروسالبية وبعد الحصول على معلومات كثيرة حولها؛ وضع العلماء مقياس لقياس قيمة الكهروسلبية للمركبات والجزيئات. أهم هذه المقاييس:
1. مقياس بولينج
اقترح لينوس بولينج عام 1932م، مفهوم الكهروسالبية الخاص به؛ لتفسير لماذا الرابطة التساهمية بين ذرتين (A-B)، أقوى من متوسط القوة بين الروابط (A-A) و (B-B). ويعبر عن كهرسلبية بولينج ب (Xr)، الذي يأخذ قيم نسبية بين 0.79 إلى 3.98.
ولحساب كهرسلبية بولينج لا بد من معرفة قيم طاقات التفكك لنوعين على الأقل من الروابط التساهمية المشاركة التي كونها هذا العنصر.
وحسب بولينج فإن الفرق في السالبية الكهربية بين ذرتين A و B يمكن إيجاده من العلاقة:
|XA - XB| = (eV)-1/2√[Ed(AB) - {(Ed(AA + BB))/2}]
بحيث: أن (Ed) هو طاقة التفكك للروابط (A-B) و (A-A) و (B-B) بوحدة الإلكترون فولت. وتم تضمين العامل eV-1/2 للحصول على نتيجة بلا أبعاد.
بسبب التعامل مع الفرق في الكهروسلبية، تم اختيار الهيدروجين كمرجع بسبب قدرته على تشكيل روابط تساهمية مع أغلب العناصر الكيميائية. وتم تعديل قيمة السالبية الكهربائية للهيدروجين من 2.1 إلى 2.2.
مع التجارب وصل بولينج إلى صيغة أكثر دقة في التعبير عن الكهرسلبية وهي كالتالي:
Ed(AB) = \frac{[Ed(AA+BB)]}{2} + (X_A - X_B)^2 eV
أو باستخدام هذه المعادلة وهي الأكثر دقة:
Ed(AB) = √[Ed(AA)Ed(BB)] + 1.3(X_A - X_B)^2 eV[4].
يمكن توضيح مفهوم مقياس بولينج في:
- أنه يعتمد على طاقة التفكك للرابطة التساهمية.
- أنه يعطي قيمًا نسبية للسالبية الكهربية.
- أنه يعتمد على الهيدروجين كمرجع.
- أنه لا يعتبر العوامل الأخرى التي قد تؤثر على السالبية الكهربية، مثل حجم الذرة وتوزيع الإلكترونات.
2. مقياس موليكن Milliken
طور روبرت موليجين (1896-1986؛ الحائز على جائزة نوبل في الكيمياء 1966) نموذجا خاصا به لتقدير السالبية الكهربية. وهذا النموذج يشير إلى أن العناصر الكيميائية ذات الطاقات التأين الأولى الكبيرة تميل إلى أن يكون لها ألفة سلبية للغاية مع الإلكترونات، واكتساب إلكترونات في التفاعلات الكيميائية. على العكس من ذلك، تميل العناصر ذات طاقات التأين الأولى الصغيرة إلى أن تكون لها ألفة إلكتروية سلبية قليلة (أو حتى موجب) وتفقد الإلكترونات في التفاعلات الكيميائية.
لاحظ موليكين أن ميل الذرات لاكتساب أو فقدان الإلكترونات ممكنا ما يعني وصفه كميًا من خلال متوسط قيمة طاقة التأين الأولية وقيمة الألفة الإلكترونية المطلقة.
اقترح روبرت إس موليكن الوسط الحسابي لطاقة التأين الأولى (E_ {I_1}) أوEI,1والألفة الإلكترونية(E_ {ea}) لقياس ميل الذرات لجذب الإلكترونات. نظرًا لأن هذا التعريف لا يعتمد على مقياس نسبي إفتراضي، فإنه يُعرف أيضًا باسمEeaالكهربية المطلقة.
باستخدام تعريفنا للألفة الإلكترونية، يمكننا كتابة التعبير الأصلي للسلبية الكهربية لموليكن على النحو التالي: يستخدم تعريف موليكن طاقة التأين وحجم الألفة الألكترونية. بالتعريف، حجم الكمية هو رقم موجب. ينتج عن تعريفنا للألفة الألكترونية قيمًا سالبة لمعظم العناصر الإلكترونية المتآلفة، لذا فإن الخط العمودي ضروري لتمثيل القيمة المطلقة في المعادلة التالية:
X = \frac{|E_{I,1} + E_{ea}|}{2}
حيث أنEI,1 طاقة التأين الأولى و Eea طاقة الألفة الألكترونية.
موليكن لديه معادلة خطية تشبه معادلات بولينج لتحويل القيم المطلقة.
XMulliken= 0.187(EI,1+Eea) + 0.17
وعند التعبير عن الطاقة بالكيلوجول/مول تصبح كالتالي:
XMulliken = (1.97×10^-3)(EI,1 +Eea) +0.19[5]
المصادر
- BYJU'S, Chemistry, Classification of Elements and Periodicity in Properties, Electronegativity.
- ويكيبيديا، كهرسلبية
- wikiHow Calculate Electronegativity
- Wikipedia, electronegativity.
- Libre texts, Mulliken electronegativity.
- Therald Moeller. John C. Bailar, Jr. Jacob kleinberg. Cyrus O. Guss. Mary E. Castellion. Clyde Metz. (1980), Chemistry with inorganic qualitative analysis. Book. Academic press